تعادل 3

تغییرات آهنگ واکنش در هنگام نزدیک شدن واکنش به حالت تعادل:
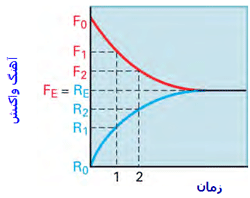
به شکل زیر توجه کنید؛ در لحظهی t=0 مقدار زیادی از مولکولهای A و B وجود دارد (در t=0 محصول AB تشکیل نشده است) و واکنش رفت سریع است (آهنگ واکنش رفت با Fo نشان داده میشود) و واکنش برگشت اتفاق نیفتاده است (آهنگ واکنش برگشت با Ro نشان داده میشود).
با گذشت زمان، AB تشکیل میشود و A و B مصرف میشوند، بنابراین طبیعی است که آهنگ رفت و برگشت تغییر کند. هر چه زمان میگذرد، واکنش رفت کندتر شده (A و B کمتری باقی مانده) و واکنش برگشت سرعت میگیرد (مولکولهای AB بیشتری تولید شده است).
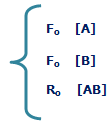
آهنگ واکنش:
در حالت تعادل، آهنگ واکنش رفت و برگشت دقیقاً با هم مساوی خواهند بود:
 |
 |
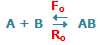 |
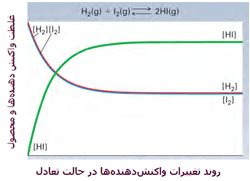
به عنوان یک مثال از بحث قبلی، واکنش گاز هیدروژن با گاز ید را در نظر میگیریم:
این دو گاز برای تشکیل یدید هیدروژن (HI) با هم وارد واکنش میشوند. هنگامی که سیستم به تعادل میرسد، آهنگ واکنش رفت و برگشت کاملاً با هم برابر میشوند و غلظت نسبی HI، H2 و I2 ثابت باقی میماند. در حالت تعادل، مقدار HI از H2 و I2 بیشتر است. در شکل زیر، روند این واکنش را مشاهده میکنید.
منظور از [HI] غلظت مولکولهای HI در واکنش است.
ثابت تعادل:
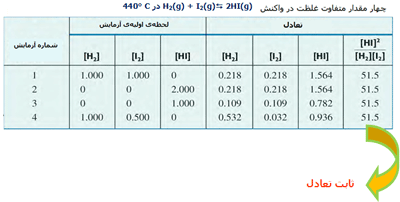
در واکنش ید و هیدروژن و تشکیل یدید هیدروژن، مقادیر نسبی HI، I2 و H2 در سیستمهای تعادلی مختلف با ثابت تعادل واکنش تعریف میشود. این مقادیر در جدول زیر آمدهاند.
حال ببینیم چگونه میتوان ثابت تعادل را محاسبه کرد؟
برای هر واکنش شیمیایی در یک دمای معین، نسبت حاصلضرب غلظت اجزای سمت راست واکنش که هر کدام از آنها به توان ضریب خود (تعداد آن محصول) میرسد، به حاصلضرب غلظت اجزای سمت راست واکنش که آنها نیز به توان ضریب خود میرسند، مقدار ثابتی دارد که به آن ثابت تعادل (K) گفته میشود.
در واکنش زیر، محاسبهی ثابت تعادل با استفاده از روش ذکر شده بدین صورت خواهد بود:
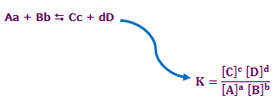
K ثابت تعادل واکنش بوده و مستقل از دما و نوع واکنش است.
به عنوان مثال محاسبهی ثابت تعادل واکنش، معادلهی زیر را در نظر میگیریم:
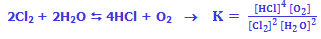
مواد واکنش دهندهی جامد و مایع در اکثر واکنشهای شیمیایی، غلظتهای ثابتی دارند و در محاسبهی K از آنها صرفنظر میشود:
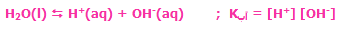
مقدار ثابت تعادل اطلاعات جالبی راجع به غلظت مواد درگیر واکنش و مورد توجه بودن واکنش رفت یا برگشت به ما می دهد؛ به عنوان مثال وقتی می گوییم مقدار K یک واکنش 1 * 109 است، یعنی غلظت محصولات به طور چشم گیری بیش تر از غلظت واکنشدهنده هاست ( 109 * 1 برابر غلظت واکنش دهنده ها است). برای نمکهایی که به سختی در آب حل می شوند، KSP تعریف می شود که ثابت حاصلضرب انحلال پذیری نام دارد.
مقدار K هر چه که باشد، میتوان آنرا اینگونه تفسیر کرد:

وقتی [ محصولات ] > [ واکنشدهندهها ] و K بزرگ است:
- واکنش، تشکیل محصولات را آسان میکند.
- واکنش در جهت رفت پیشرفت کرده است.

وقتی [ واکنشدهندهها ] > [ محصولات ] و K کوچک است:
- واکنش، تشکیل محصولات را آسان میکند.
- واکنش در جهت برگشت پیشرفت کرده است.

وقتی K از 0.1 تا 10 تغییر میکند و [ محصولات ] تقریبا مساوی با [ واکنشدهندهها ]:
- مقادیر قابل توجه و محسوسی از هر دو موجود است.
در تمام موارد بالا، سیستم در حالت تعادل قرار دارد.
مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
برچسبها:






 آمار
وب سایت:
آمار
وب سایت:

